Kąt zwilżania, napięcie powierzchniowe
Napięcie powierzchniowe – siły i oddziaływania powierzchniowe
Układy fizyczne dążą do stanów o najmniejszej energii, gdyż tylko takie układy są stabilne. Ciecz pozostawiona samej sobie dąży do przybrania postaci, w której jej powierzchnia jest przy danej objętości najmniejsza (kula), gdyż wtedy osiągane jest minimum energii potencjalnej [1]. Wzdłuż powierzchni cieczy (stycznie do jej powierzchni) działają siły, które zostały nazwane siłami napięcia powierzchniowego. Aby zrozumieć jak działają te siły należy wziąć pod uwagę, że oprócz sił przyciągania na cząsteczki warstwy powierzchniowej działają także inne siły, które nie pozwalają cząsteczkom przemieszczać się w głąb cieczy [2]. Wypadkowa tych sił odpowiedzialna jest za powstanie napięcia powierzchniowego.
W warstwie powierzchniowej zachodzą następujące procesy. W pobliżu powierzchni zachodzi równowaga dynamiczna: liczba cząsteczek, które w każdej sekundzie docierają na powierzchnię z głębszych warstw cieczy, jest równa liczbie cząsteczek opuszczających warstwę powierzchniową i wędrujących w głąb cieczy. Aby cząsteczka przeszła z głębi na powierzchnie musi ona „rozsunąć’ cząsteczki warstwy powierzchniowej, pokonując siły przyciągania ze strony innych cząsteczek położnych głębiej , które wykazują tendencję do utrzymania cząsteczki głębiej. Cząsteczka wędrująca w odwrotnym kierunku musi jedynie rozsunąć cząsteczki warstwy wewnętrznej. Stąd wniosek, że cząsteczce trudniej jest wydostać się z głębi na powierzchnie niż powrócić z powierzchni w głąb. Dlatego równowaga dynamiczna jest możliwa tylko wtedy, gdy gęstość cząsteczek w warstwie powierzchniowej jest mniejsza niż w warstwie o takiej samej grubości w głębi cieczy. Warstwa powierzchniowa jest więc jakby naciągnięta w porównaniu z resztą cieczy. Mniejsza gęstość warstwy powierzchniowej jest potwierdzona doświadczalnie (odbicie światła spolaryzowanego).
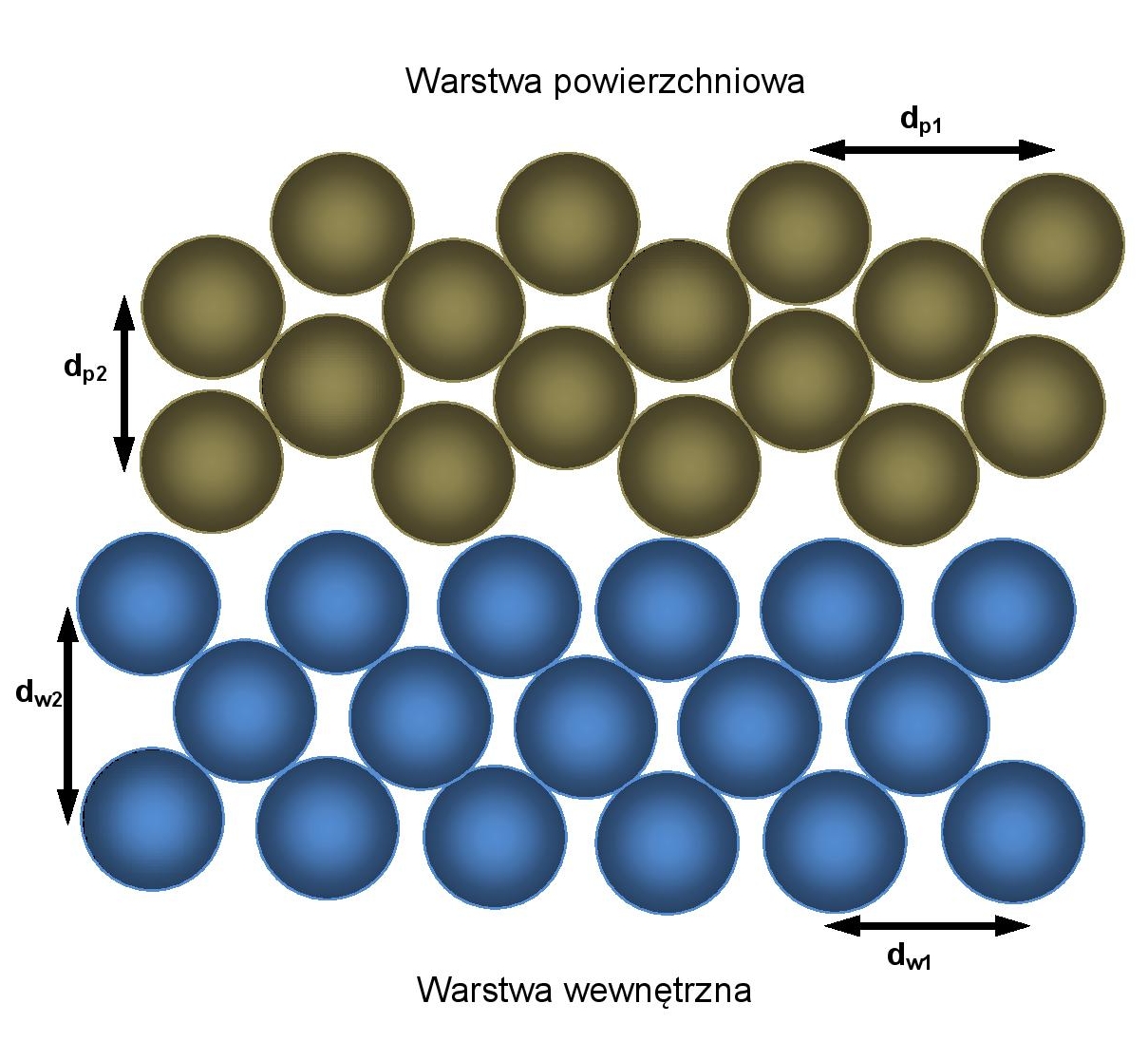
Energia powierzchniowa a napięcie powierzchniowe
Z powyższych rozważań wynika, że cienka warstwa powierzchniowa cieczy składa się z cząsteczek będących w innym stanie energetycznym niż cząsteczki wewnątrz cieczy [1]. Cząsteczki powierzchniowe ulegają działaniu niesymetrycznych międzycząsteczkowych sił przyciągania, wskutek czego w warstwie powierzchniowej wytwarza się dodatkowa energia powierzchniowa, której nie posiadają cząsteczki we wnętrzu cieczy. Energia powierzchniowa nadaje szczególne właściwości warstwie powierzchniowej. Grubość warstwy powierzchniowej , równa jest średnicy działania sfery sił międzycząsteczkowych i wynosi kilka warstw cząsteczkowych praktycznie nie przewyższając odległości 10-9 m. Rysunek po lewej stronie schematycznie pokazuje różnice pomiędzy warstwą powierzchniową i wewnętrzną. Odległości pomiędzy cząsteczkami w warstwie powierzchniowej cieczy dp1 w płaszczyźnie równoległej do styku faz są największe. Ich energia potencjalna odwzorowana na wykresie potencjału Lennarda – Jonesa odpowiada zakresowi znajdującemu się po prawej stronie wielkości r0 . Natomiast odległości pomiędzy cząsteczkami w płaszczyźnie prostopadłej do styku faz dp2 są najmniejsze, zaś ich energia potencjalna odwzorowana na wykresie potencjału Lennarda – Jonesa odpowiada zakresowi znajdującemu się po lewej stronie wielkości r0. Odległości pomiędzy cząsteczkami w warstwie wewnętrznej zarówno w płaszczyźnie równoległej do granicy faz dw1 jak i prostopadłej dw2 są w przybliżeniu równe, a ich energie potencjalne oscylują wokół wartości odpowiadającej odległości r0wykresu potencjału Lennarda – Jonesa.
Przykładowe wielkości napięcia powierzchniowego:
|
Związek |
σ (mN/m) |
|
Woda |
71,97 |
|
Nitrobenzen |
41,8 |
|
Benzen |
28,87 |
|
Czterochlorek węgla |
26,8 |
|
Aceton |
23,7 |
|
Alkohol etylowy |
22,3 |
|
Eter etylowy |
17,0 |
|
Rtęć |
428,0 |
Równowaga sił na granicy ciecz – gaz – ciało stałe
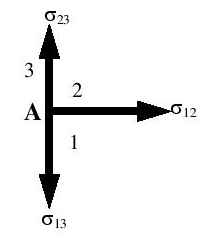
W wyniku napięcia powierzchniowego pozioma powierzchnia cieczy ulega zakrzywieniu w pobliżu ścianek naczynia tworząc menisk wklęsły lub wypukły [1]. Na rysunku z lewej strony rozpatrywany jest układ sił działający na granicy trzech ośrodków:ciecz, gaz, ścianka naczynia. Cząsteczka cieczy ulega działaniu trzech sił napięcia powierzchniowego leżących w trzech powierzchniach rozdziału: σ13 – między cieczą, a ścianką, σ23 – między gazem i ścianką, σ12 – między cieczą i gazem. Początkowy kierunek tych sił pokazany jest na rysunku obok. Ponieważ z zasady σ23 nie równa się σ13 , ciecz w pobliżu punktu A wzniesie się lub opuści wzdłuż ścianki w zależności od tego, która z z dwóch sił jest większa. Przypuśćmy, że σ23 > σ13 . Wówczas powierzchnia rozdziału obniży się tworząc menisk wklęsły, a siła σ12 będzie miała kierunek styczny do zakrzywionej powierzchni cieczy. Składowa pionowa tej siły wynosi σ12·cosθ, gdzie kąt θ jest kątem pomiędzy ścianką i styczną do krzywizny cieczy w punkcie A. Równowaga siły wystąpi wówczas, gdy:
W tym przypadku menisk będzie wklęsły. Jeśli σ23 < σ13 , to ciecz przy ściance obniży się. Warunek równowagi pozostanie ten sam, a menisk będzie wypukły.
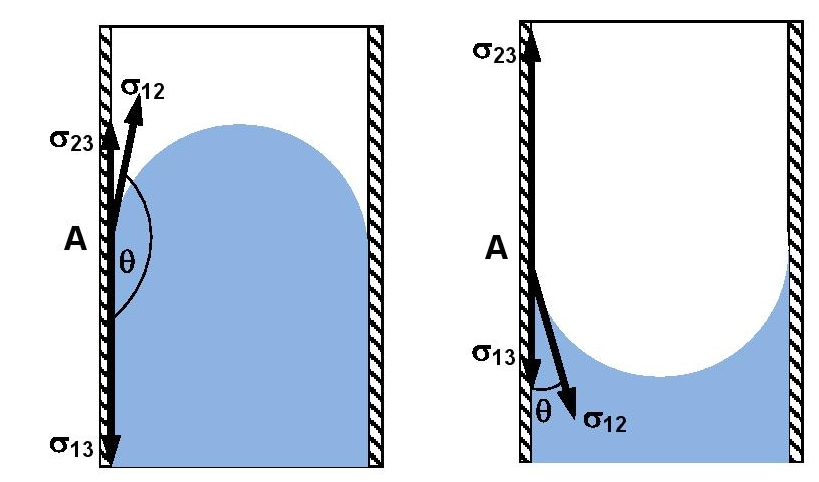
W obu przypadkach:
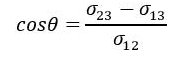
Kąt θ nazywany jest kątem granicznym (kątem zetknięcia). Jeśli cosθ > 0, to menisk jest wklęsły; ciecz zwilża ściankę. W przeciwnym przypadku, gdy cosθ > 0, to menisk jest wypukły; ciecz nie zwilża ścianki.
Napięcie powierzchniowe a siła wyporu- ciało w cieczy
W przypadku pływania ciał w cieczy zjawisko zwilżania lub jego brak powoduje powstanie dodatkowych sił, które zwiększają lub zmniejszają siłę wyporu [2]. Jeżeli ciecz zwilża ciało stałe, to napięcie powierzchniowe stara się wciągnąć ciało głębiej do cieczy – działa przeciwnie do siły wyporu. Jeżeli ciecz nie zwilża ciała stałego , to siły napięcia powierzchniowego są skierowane do góry i starają się wypchnąć ciało z cieczy. Te dodatkowe siły są są zazwyczaj niewielkie w porównaniu z siłą wyporu Archimedesa, ale w szczególnych przypadkach mają znaczenie. Takim szczególnym przypadkiem jest sytuacja gdy gęstość ciała pływającego jest tylko nieznacznie większa od gęstości cieczy, a powierzchnia styku ciała z cieczą ma duży obwód (tzw. obwód zwilżania). W takim przypadku może się zdarzyć, że ciało nie tonie w wyniku działania sił napięcia powierzchniowego, jeśli ciecz nie zwilża tego ciała.
Ciśnienie pod powierzchnia zakrzywioną
Jeżeli powierzchnia nie jest płaska, to istnienie napięcia powierzchniowego powoduje pojawienie się ciśnienia ze strony warstwy powierzchniowej na warstwy położone głębiej. W ogólnym przypadku krzywizna powierzchni określona jest przez dwa promienie krzywizny r1 i r2 we wzajemnie prostopadłych płaszczyznach i dodatkowe ciśnie nie określone jest wzorem [2]:
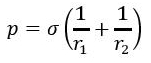
Włoskowatość (kapilarność)
Wzajemne oddziaływanie cieczy ze ścianką naczynia powoduje podniesienie się lub obniżenie poziomu cieczy poprzez siły napięcia powierzchniowego [2]. Jeżeli ścianki są zwilżane przez ciecz to poziom podnosi się, w przeciwnym przypadku obniża się. Ciśnienie słupa cieczy w rurce o wysokości h jest zrównoważone ciśnieniem sił napięcia powierzchniowego. W przypadku rurki o przekroju kołowym o promieniu r, promieniu krzywizny powierzchni cieczy R i gęstości cieczy ρ słuszny jest związek:
ρgh = 2σ/R = 2σcosθ/r
Powyższy wzór jest słuszny zarówno dla podnoszenia się cieczy, jak i obniżania. Wysokość (głębokość) h rośnie wraz ze zmniejszaniem się promienia rurki r. Efekt ten jest znaczny dla bardzo wąskich rurek zwanych włoskowatymi lub kapilarnymi.
Pomiar napięcia powierzchniowego
Wysokość wzniesienia się cieczy w naczyniu, którego ścianki ona zwilża, jest ograniczona, ponieważ przy określonej wysokości słupa podniesionej cieczy siła ciążenia przeciwdziała dalszemu podnoszeniu się cieczy [1]. Wznoszenie cieczy w kapilarze umożliwia pomiar napięcia powierzchniowego. Jeśli ciecz o gęstości ρ podniosła się na wysokość h w rurce o promieniu r, to ciężar słupa cieczy wynosi πr2hρg, gdzie g jest przyspieszeniem ziemskim. Siła napięcia powierzchniowego wynosi σ·2πr. W stanie równowagi obie siły są równe:
πr2hρg = σ·2πr
a stąd napięcie powierzchniowe:
σ = 0,5·rhρg
Innym sposobem wyznaczenia napięcia powierzchniowego jest użycie stalagmometru. Pomiar opiera się na wyznaczeniu wielkości kropel wyciekających z kapilary tak jak na rysunku obok. Ciężar kropli Q w momencie odrywania się jej jest równy sile napięcia powierzchniowego działającej wzdłuż obwodu przewężenia o średnicy d pomiędzy odrywającą się kroplą, a resztą cieczy w rurce:
Q = σ·πd
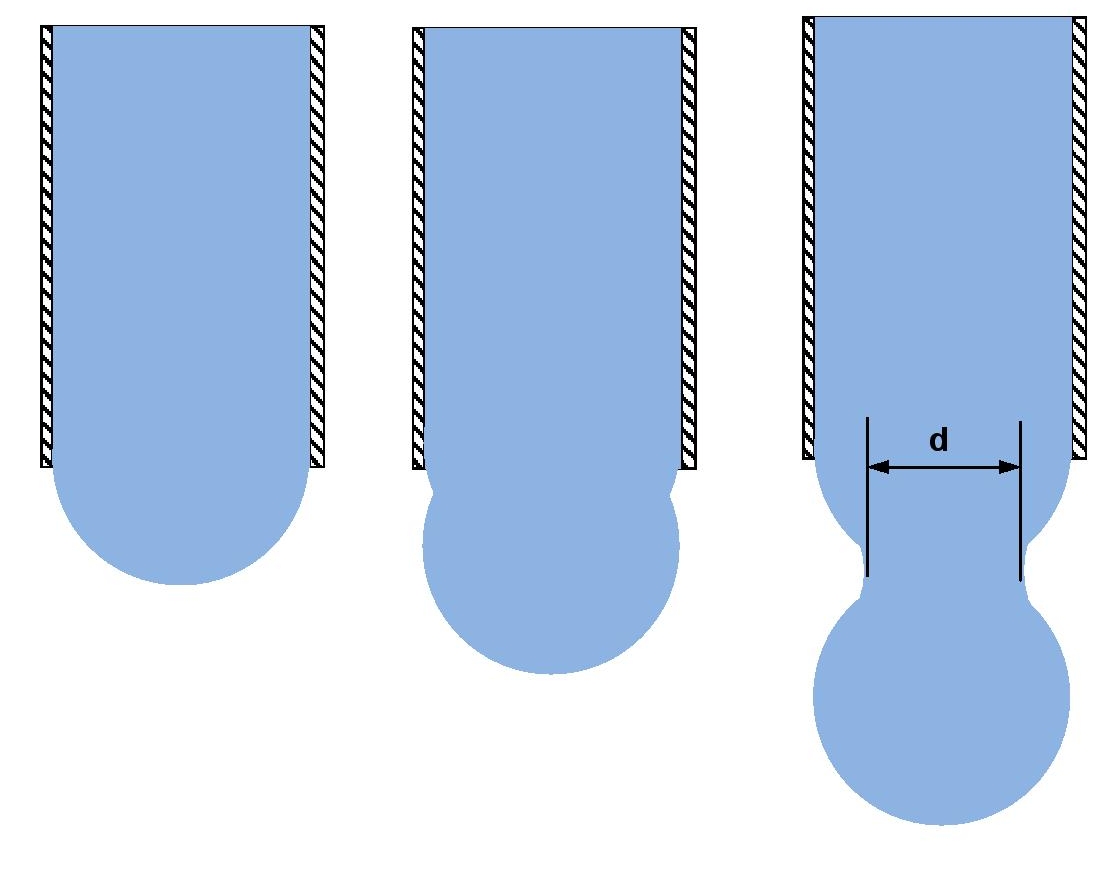
Innym sposobem wyznaczenia napięcia powierzchniowego jest użycie stalagmometru. Pomiar opiera się na wyznaczeniu wielkości kropel wyciekających z kapilary tak jak na rysunku obok [3]. Ciężar kropli Q w momencie odrywania się jej jest równy sile napięcia powierzchniowego działającej wzdłuż obwodu przewężenia o średnicy d pomiędzy odrywającą się kroplą, a resztą cieczy w rurce:
Q = σ·πd
Czyli napiecie powierzchniowe wynosi:
σ = Vρg/(πnd)
Średnicę przewężenia cieczy można wyznaczyć fotografując przebieg pomiaru.
Odmianą tej metody jest metoda porównawcza [1]. Przyrząd napełnia się wodą, a następnie badaną cieczą i liczy się krople. Objętości cieczy są w obu przypadkach jednakowe czyli szukane napięcie powierzchniowe σ badanej cieczy wynosi:
σ = σw·[(ρ·nw) /(ρw·n)]
gdzie σw – napięcie powierzchniowe wody, nw – liczba kropel wody, ρw – gęstość wody, n – liczba kropel badanej cieczy, ρ – gęstość badanej cieczy.
W roku 1926 roku P. A. Rebinder [1] opracował metodę opartą na obserwacji, że ciśnienie niezbędne do wypchnięcia cieczy (lub gazu) z kapilary zanurzonej w drugiej cieczy jest proporcjonalne do napięcia powierzchniowego na granicy obu cieczy. Stąd σ = const·p, gdzie współczynnik jest stały dla danego przyrządu, a p – ciśnienie przy którym przeskakuje pęcherzyk. Zastępując badana ciecz wodą otrzymuje się zależność: σw = const·pw , stąd const = σw/ pw . Wartość σw jest znana, a pw wyznacza się doświadczalnie.
Zależność napięcia powierzchniowego od temperatury
Napięcie powierzchniowe w dużym zakresie temperatur zależy liniowo od temperatury. Zależność liniowa zanika w temperaturze bliskiej temperatury krytycznej. Dla prostoliniowej części tej zależności prawdziwe jest równanie[4]:
σ = k(Tz – T)
gdzie k – ozacza stały współczynnik równy 2,1·10-7 J·K-1, a Tz jest temperaturą bliską temperaturze krytycznej, często niższą od niej o około 6 K.
Ta zależność nazywana jest prawem Eötvösa.
Parachora i refrachora
Między napięciem powierzchniowym σ na granicy cieczy – para nasycona i gęstościami obu faz zachodzi następująca zależność [4, 5]:
σ = C( ρc – ρp)4
gdzie C jest stałą zależna od substancji, ρc – gęstość cieczy, ρp – gęstość pary.
Po przekształceniach powyższego równania otrzymuje się wzór:
P = MC1/4 = Mσ1/4/( ρc – ρp)
gdzie P nosi nazwę parachory.
Inną wielkością związaną częściowo z parachora jest refrachora F, zdefiniowania równaniem [5]:
F = – Plog(n20D – 1)
gdzie P oznacza parachorę, a n – współczynnik załamania
Potencjał Lennarda – Jonesa
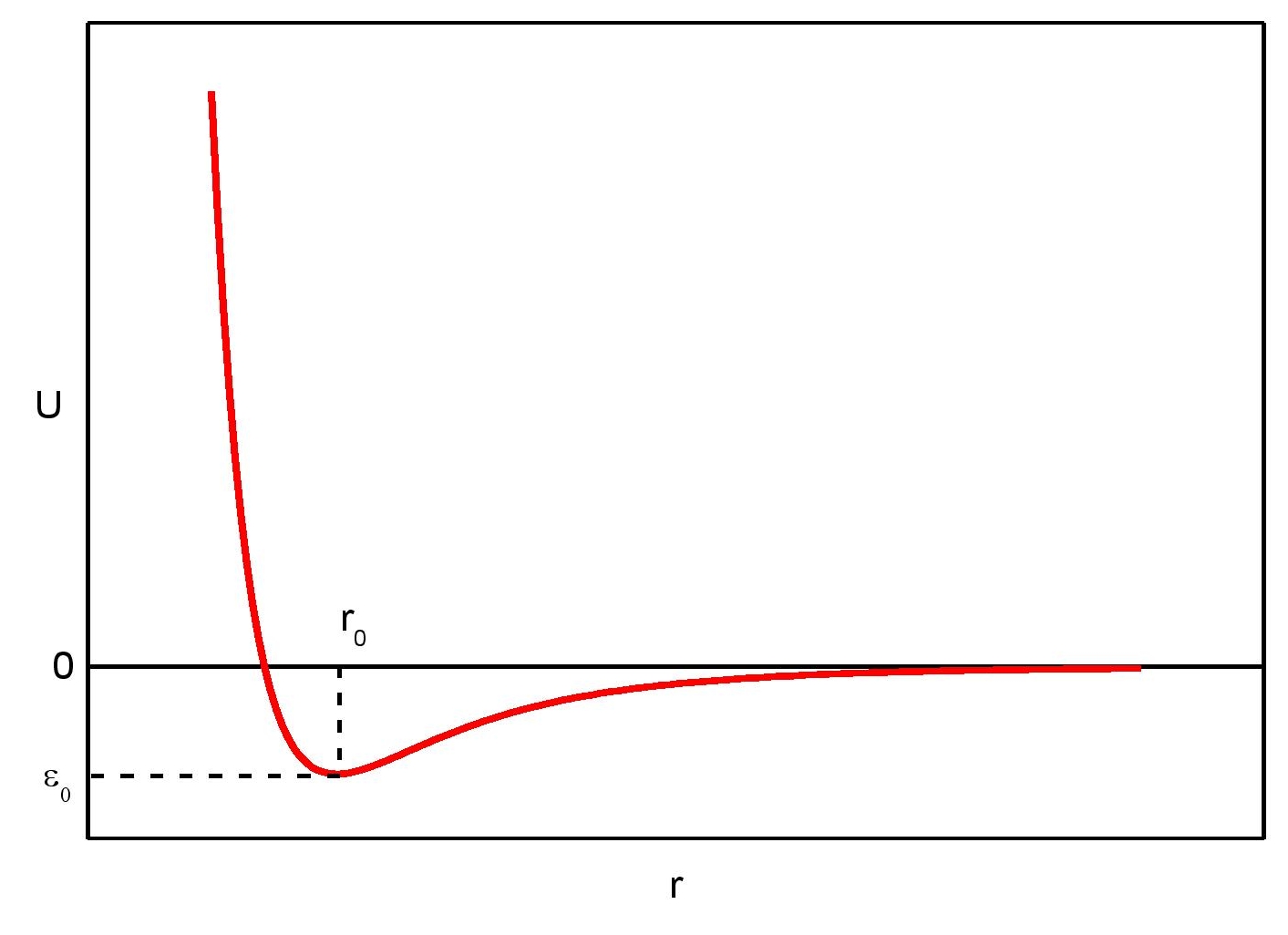
Dla małych odległości między cząsteczkami mamy do czynienia z odpychaniem [2]. Jest to wynikiem niezerowej objętości cząsteczki. Do obszaru zajmowanego przez jedną cząsteczkę nie może wniknąć inna. Zasięg działania sił odpychania jest mały, rzędu liniowych rozmiarów cząsteczki. Charakter zmian energii potencjalnej oddziaływania w zależności od odległości r pomiędzy cząstkami jest przedstawiony na rysunku z lewej strony. Dla r > r0 cząsteczki przyciągają się, a dla r < r0 – odpychają się. Dokładny przebieg zależności energii potencjalnej U w zależności od r może być podany jedynie dla konkretnych dwóch cząsteczek. Nie ma uniwersalnego wzoru na U(r), słusznego dla wszystkich cząsteczek. Zazwyczaj funkcję U(r) aproksymuje się wzorem typu:
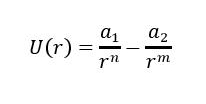
gdzie stałe a1 , a2 , m,n dobiera się tak, aby wzór najlepiej przybliżał rzeczywisty potencjał oddziaływań. Odpowiednie badania wykazały, że dobrym przybliżeniem jest powyższy wzór dla n = 12 i m = 6, przy czym a1 i a2 są dobierane dla danych cząsteczek. Potencjał zapisuje się wtedy w następującej postaci:
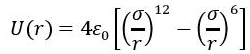
gdzie σ zdefiniowane jest jako odległość dla zerowej wartości energii potencjalnej, a ε0 – minimum energii potencjalnej (odpowiada odległości punktu równowagi). Wzór ten określa tzw. potencjał Lennarda – Jonesa, który jest szeroko wykorzystywany w teorii cieczy i gazów. Potencjał ten jest potencjałem dwucząstkowym, to znaczy siła oddziaływań pomiędzy dwiema cząsteczkami nie zmienia się, gdy pojawia się trzecia cząsteczka. Ściśle biorąc nie może to być prawdą, gdyż trzecia cząstka powoduje rozsunięcie różnoimiennych ładunków w cząsteczkach (polaryzacja), a więc wpływa na wzajemne oddziaływanie dwóch cząsteczek. Jednak potencjał Lennarda – Jonesa sprawdza się w wielu sytuacjach.
Charakterystyka stanu ciekłego
Ciecze zajmują pozycję pośrednia między ciałami stałymi i gazowymi. Niektóre właściwości zbliżają je, zwłaszcza w temperaturach niskich do ciał stałych, inne zaś właściwości – do gazów, szczególnie w pobliżu temperatury krytycznej, w której w ogóle znika wszelka różnica między cieczą i jej parą [1].
Ciecze w odróżnieniu od gazów nie tylko nie dążą do zajęcia możliwie największej objętości, lecz na odwrót, silnie sprzeciwiają się zmianie objętości. Współczynnik ściśliwościχ różnych cieczy i ciał krystalicznych w temperaturze około 00C i pod umiarkowanym ciśnieniem leży w przedziale od 2·10-11 do 2·10-9 Pa-1; tak np. dla wody wynosi w 200 C χ=45·10-6, co oznacza, że do zmniejszenia objętości wody o 1% potrzeba ciśnienia 2·107 Pa. Dla uzyskania tego efektu w przypadku gazu doskonałego wystarczy zmienić ciśnienie o 1 % czyli przy 105 Pa stanowi to zaledwie 103 Pa, czyli 20 000 razy mniej niż w przypadku wody.
Dwoisty charakter właściwości cieczy jest spowodowany osobliwościami ruchu ich cząstek W gazach cząsteczki poruszają się zupełnie chaotycznie, natomiast w ciałach stałych krystalicznych, cząsteczki drgają względem określonych położeń równowagi. W odróżnieniu od ciał stałych, te położenia równowagi każdej cząstki nie jest stałe. Po upływie pewnego czasu τ odległości między nimi są rzędu 10-10 m.
Ciecze mogą bez rozerwania wytrzymać bardzo silne rozciągania, jeżeli te rozciągania sprowadzają się do wszechstronnego ujemnego ciśnienia, wykluczającego możliwość przepływu cieczy.
Analiza pewnych właściwości ciał płynnych i stałych prowadzi do wniosku, że różnice między nimi nie są tak znaczne. Doświadczenie wskazuje, że ciała krystaliczne maja pewną, choć niewielką płynność. Płynność ciał stałych przejawia się w deformacji plastycznej w wyniku działania sił ścinających. Z drugiej strony, ciecze mają pewna sprężystość ścinania, którą trudno zauważyć wskutek dużej płynności. Na przykład, w procesie twardnienia szkła jego płynność nie znika nagle, ale zmniejsza się stopniowo, przy czym coraz większą rolę odgrywają właściwości sprężyste, charakterystyczne dla ciał stałych. Płynność i sprężystość nie są właściwościami wykluczającymi się wzajemnie.
Rentgenowska analiza strukturalna cieczy wykazała, że w temperaturze bliskiej temperaturze krystalizacji, rozmieszczenie cząstek w cieczach nie jest całkowicie chaotyczne, jak w gazach, ale jest podobne do do prawidłowego rozmieszczenia, które cechuje szkła. Wyniki badania rentgenograficznego budowy cieczy wykazują, że nie wszystkie odległości między cząsteczkami są jednakowo prawdopodobne. Wzajemny układ sąsiednich cząstek podlega prawidłowości w pewnym stopniu podobnej do rozmieszczenia sąsiednich atomów w kryształach. W miarę zwiększania odległości od umownie wybranej „centralnej” cząstki stopniowo zmniejsza się uporządkowanie względem tej cząstki i przy odległości równej siedmiu efektywnym średnicom cząstki takie uporządkowanie praktycznie zanika. Taka zależność określana jest jako „bliskie uporządkowanie” lub „uporządkowanie bliskiego zasięgu” w przeciwieństwie do kryształów gdzie występuje „uporządkowanie dalekie” lub „uporządkowanie dalekiego zasięgu” czyli regularne uporządkowanie cząsteczek, atomów lubjonów w materiałach, występujące w obszarze, którego rozmiar w najdłuższym kierunku jest wielokrotnie większy od rozmiarów porządkujących się cząsteczek.
Rentgenogramy cieczy są podobne do rentgenogramów ciał mikrokrystalicznych, tzn. ciał składających się z bardzo drobnych kryształów o wymiarach liniowych rzędu 10-9 m, różnie zorientowanych względem siebie. To sugeruje, że chwilowe uporządkowanie cieczy przypomina rozmieszczenie atomów w ciele stałym składającym się z wielkiej liczby chaotycznie rozrzuconych kryształków o rozmiarach submikroskopowych (obszary sibotaksyczne). W granicach takiego obszaru rozmieszczenie cząstek, lub ich orientacja, zachowuje wystarczająca prawidłowość, zmieniając się od jednego obszaru sibotaksycznego do drugiego. Ta struktura cieczy szybko zmienia się z upływem czasu wskutek intensywnego ruchu cieplnego, który słabnie wraz z malejącą temperaturą. Wynika stąd wniosek, że nie ma wyraźnej granicy w budowie pomiędzy stanem ciekłym i stałym danej substancji w temperaturach bliskich temperaturze krystalizacji.
Liczne właściwości fizyczne cieczy mało różnią się od fizycznych własności ciał stałych. Na przykład, przy topnieniu ciał stałych względne powiększenie objętości jest bardzo niewielkie (rzędu 10%). Wynika to stąd, że średnie odległości między cząsteczkami w procesie topnienia prawie nie ulegają zmianie, podczas gdy przy parowaniu zmieniają się znacznie.
Przy topnieniu ciał ich ciepło właściwe prawie nie ulega zmianie (tabela poniżej [3]).
|
Substancja |
Ciepło topnienia |
Ciepło parowania |
|
Sód |
2,6·106 |
9,8·107 |
|
Rtęć |
2,3·106 |
6,0·107 |
|
Ołów |
4,9·106 |
1,9·108 |
Czyli charakter ruchu cieplnego cząstek substancji w procesie topnienia praktycznie niewiele się zmienia. Ruch jednoatomowych cząsteczek cieczy w temperaturach bliskich temperaturze topnienia, sprowadza się do małych wahań dookoła pewnych położeń równowagi, które od czasu do czasu zmieniają się skokami, ponieważ atomy przeskakują w inne położenie. W przypadku cząstek dwu i więcej atomowych ruch sprowadza się dodatkowo do wahań obrotowych dookoła pewnych określonych kierunków, które z czasem też mogą zmieniać się skokowo.Porównanie ciepła topnienia i parowania podane w tabeli poniżej pokazuje, że ciepło parowania jest kilka dziesiątków razy większe od ciepła topnienia. To świadczy o bardzo nieznacznych zmianach wzajemnego rozmieszczenia cząstek substancji przy jej przejściu ze stanu krystalicznego w ciekły.
|
Substancja |
w stanie stałym |
w stanie ciekłym |
|
Sód |
3,2·104 |
3,3·104 |
|
Rtęć |
2,8·104 |
2,8·104 |
|
Cynk |
3,0·104 |
3,3·104 |
|
Wodór |
4,7·104 |
5,5·104 |
|
Benzen |
11,2·104 |
12,6·104 |
Z powodów powyżej opisanych cech stanu ciekłego teoria cieczy wciąż jest w stadium opracowywania.
Literatura
[1] A. Brodski „Chemia Fizyczna”, tom pierwszy, PWN, Warszawa 1954
[2] A. N. Matwiejew „Fizyka Cząsteczkowa”, PWN, Warszawa, 1989
[3] B. Jaworski, A. Dietłaf, Ł. Miłkowska, G. Siergiejew „Kurs Fizyki”, tom 1, PWN, Warszawa, 1984
[4] W. Tomassi, H. Jankowska „Chemia Fizyczna”, WNT, Warszawa, 1980
[5] T. Drapała „Chemia Fizyczna z Zadaniami”, PWN, Warszawa – Poznań, 1982
Zapraszamy również do zapoznania się z ofertą aparatury pomiarowej z serii SURFTENS firmy OEG, która jest przeznaczona do pomiaru kąta zwilżania oraz napięcia powierzchniowego cieczy.





